Arzneimittelherstellung des bispezifischen PSMAxCD3-Antikörpers CC-1 zur Durchführung einer klinischen Studie an Patienten mit Plattenepithelkarzinomen der Lunge
Hauptantragsteller: Prof. Dr. med. Helmut Salih, Universitätsklinikum Tübingen
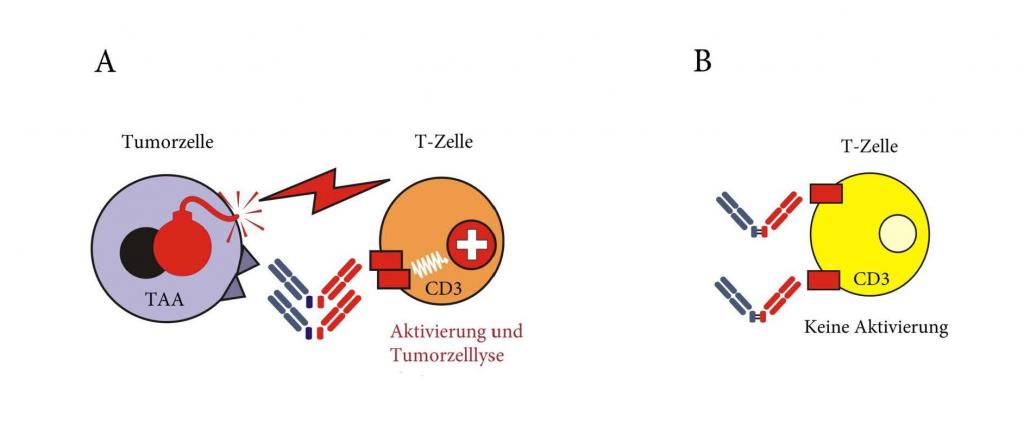
CC-1 ist ein bispezifischer Antikörper mit PSMAxCD3-Spezifität, der im Rahmen des deutschen Konsortiums für translationale Krebsforschung (DKTK) entwickelt wurde. Neben der prototypischen Bindung an Prostatakrebszellen reagiert CC-1 zusätzlich mit Plattenepithelkarzinomzellen der Lunge. Zusätzlich zu den Tumorzellen bindet CC-1 auch an Tumorgefäße, was einen dualen Wirkmechanismus ermöglicht. CC-1 wurde in einem neuartigen Format entwickelt, welches nicht nur eine bessere Serum-Halbwertszeit ermöglicht, sondern vor allem die unerwünschte „off-target“ Aktivierung von T Zellen und damit Nebenwirkungen reduziert. Zusammen mit einer präemptiven Blockade des IL-6-Rezeptors durch Verwendung von Tocilizumab ermöglicht dies die Verabreichung des Antikörpers mit entsprechend verbesserter Wirksamkeit.
Eine erste klinische Studie mit CC-1 bei Patienten mit Prostatakarzinom wurde durch die zuständige Zulassungsbehörde bereits genehmigt, und auch für die Evaluation bei Patienten mit Lungenkarzinom wurde Zustimmung signalisiert. Die Förderung des Projektes durch die ForTra gGmbH ermöglicht nun die erforderliche Produktion von zusätzlichem CC-1 Antikörper unter Good Manufacturing Practice- (GMP-) Bedingungen für die Durchführung der ersten klinischen Studie mit Lungenkarzinompatienten zur Untersuchung der Sicherheit und Wirksamkeit. Damit wird die klinische Evaluation einer neuen Immuntherapie in einer Tumorentität mit bislang unzureichenden Therapieoptionen ermöglicht und die Lücke zwischen der Entdeckung innovativer Biologicals und ihrer klinischen Evaluation geschlossen.
Weiterführende Informationen erhalten Sie hier.
Projektpartner:
Philogen S.p.A., Siena, Italy