
Die Individualstipendien – jeweils dotiert mit 350.000 Euro – gehen an folgende acht Kandidatinnen und Kandidaten:

PD Dr. Paul Bröckelmann, Klinik I für Innere Medizin, Uniklinik Köln und Max-Planck-Institut für Biologie des Alterns, Köln
Projekt: Identifikation immuntherapeutischer Schwachstellen in Tumor Ökosystemen von B-Zell Lymphomen
Lymphome sind eine heterogene Gruppe von Blutkrebserkrankungen, die nur teilweise und häufig nur vorübergehend auf aktuell verfügbare Immuntherapien ansprechen. Das Forschungsprojekt zielt darauf ab, mithilfe vielseitiger moderner Analysetechniken und genetischer Screening-Verfahren die Immunlandschaft von Lymphompatientinnen und -patienten detailliert zu charakterisieren. Das übergeordnete Ziel ist die Identifizierung von Mechanismen für das Ansprechen oder Versagen der Immuntherapie, um so neue Behandlungsstrategien zu entwickeln.

PD Dr. Markus Eckstein, Institut für Pathologie, Universitätsklinikum Erlangen, Friedrich-Alexander-Universität Erlangen-Nürnberg
Projekt: Entschlüsselung der Immuntherapie-Resistenzmechanismen bei lokal fortgeschrittenen und metastasierten Urothelkarzinomen
Muskelinvasiver und metastasierter Harnblasenkrebs gehört zu den aggressivsten Krebsarten. Trotz neuer Therapien wie der Immuntherapie haben sich die Überlebensraten in den letzten Jahrzehnten für diese Krebsart nicht signifikant verbessert. Aktuell ist es nicht möglich, mittels Biomarker vorherzusagen, welche Patientinnen und Patienten von modernen Immuntherapien profitieren. Darüber hinaus verstehen wir bislang unzureichend, warum diese Krebsart so resistent gegen Immuntherapien ist. In dem geplanten Vorhaben soll daher intensiver erforscht werden, wie Harnblasenkrebs dem Immunsystem entgeht und sich während der Metastasierung entwickelt, um neue, maßgeschneiderte immuntherapeutische Ansätze für Patientinnen und Patienten mit muskelinvasivem und metastasiertem Harnblasenkrebs zu entwickeln.
PD Dr. Tobias Faizy, Sektion Interventionelle Neuroradiologie, Universitätsklinikum Münster
Projekt: Entwicklung eines neuen bildbasierten Diagnosekonzepts zur Beurteilung von Patienten mit akutem Schlaganfall - Verbesserung der Patientenselektion und der Vorhersage des klinischen Outcomes
Während eines ischämischen Schlaganfalles können kleinste Blutgefäße, sogenannte Kollateralgefäße, vom Absterben bedrohtes Hirngewebe temporär mit Blut versorgen. Diese Kollateralgefäße sind in der Schlaganfalltherapie von äußerster Bedeutung. Im Rahmen des Projekts soll ein neues Konzept zur strukturellen Diagnose und Quantifizierung von Kollateralgefäßen des Gehirns entwickelt werden. Die Untersuchungen basieren auf Datensätzen aus der Computertomografie, die mithilfe von Künstlicher Intelligenz (KI) erzeugt werden.

PD Dr. Julian Mustroph, Klinik und Poliklinik für Innere Medizin II, Universitätsklinikum Regensburg
Projekt: Zelluläre Pathophysiologie der humanen kardialen TTR-Amyloidose
Im Rahmen einer Transthyretin-Amyloidose werden falsch zusammengesetzte Eiweiße, sogenanntes Transthyretin-Amyloid, im Herzen abgelagert. Die Erkrankung kann aufgrund der
körperlichen Alterung oder durch einen Gendefekt auftreten und führt durch
Eiweißablagerungen zu einer Herzmuskelverdickung und -versteifung. Im Rahmen des
Forschungsprojektes sollen nun erstmals kleine menschliche Herzproben von sogenannten Myokardbiopsien verwendet und daraus lebende Herzmuskelzellen untersucht werden.
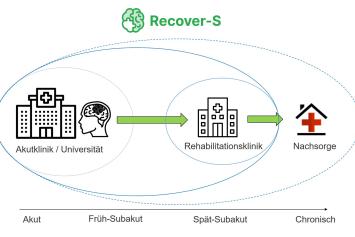
PD Dr. Alexander Nave, Klinik für Neurologie mit Experimenteller Neurologie, Charité-Universitätsmedizin Berlin
Projekt: Sektorenübergreifende Untersuchungen nach Schlaganfall – Prädiktoren der Schlaganfallerholung in der personalisierten Schlaganfallrehabilitation
Die Erholung nach einem Schlaganfall ist sehr variabel. Das sektorenübergreifende Register, RECOVER-S, untersucht die neurologische und psychische Erholung von Patientinnen und Patienten nach einem Schlaganfall und ermöglicht eine umfassende Zusammenarbeit zwischen verschiedenen Akteuren der Schlaganfallversorgung. Durch MRT- und Blutuntersuchungen sollen Biomarker der Erholung nach einem Schlaganfall identifiziert und validiert werden. In einer registerbasierten klinischen Studie soll der Einfluss von tragbaren Sensoren (wearables) auf die Motivation und den Erholungsverlauf von Schlaganfallpatientinnen und -patienten erstmals untersucht werden.
PD Dr. Jan Peeken, Klinik und Poliklinik für RadioOnkologie und Strahlentherapie, Klinikums rechts der Isar, Technische Universität München
Projekt: Individualisierte Risikobewertung unter Verwendung von KI und molekularer Bildgebung für Prostatakarzinompatienten
Die Entwicklung der Künstlichen Intelligenz (KI) bietet neue Möglichkeiten bei der Analyse medizinischer Bilddaten. KI-Algorithmen können beispielshaft Tumore nicht invasiv analysieren und Prognosen erstellen. Im Zusammenschluss mit einer Gruppe internationaler medizinischer Behandlungszentren sammeln die Forschenden Daten von Patienten mit Prostatakarzinom, die eine spezifische Form der molekularen Bildgebung (PSMA PET) vor einer radioonkologischen Behandlung erhalten haben. Die Entwicklung von spezialisierten KI-Algorithmen soll die Therapieplanung verbessern, Tumore besser charakterisieren und Ärztinnen und Ärzten bei der Prognoseeinschätzung unterstützen. Die entwickelten Modelle sollen schließlich in einer klinischen Studie erprobt werden.
PD Dr. Adrian Regensburger, AG Translationale Pädiatrie, Kindergastroenterologie und Kinderultraschall, Kinder- und Jugendklinik, Uniklinikum Erlangen
Projekt: Translationale Optoakustische Biomarker für Erkrankungen des Gastrointestinaltraktes
Während die Behandlung von Kindern und Jugendlichen immer komplexer wird und Strukturen auf immer kleinerer Ebene bis hin zu den Genen adressiert werden, fehlen Ärztinnen und Ärzten häufig geeignete Instrumente zur Beurteilung des Therapieerfolgs. Neuartige, schonende Bildgebungsverfahren, wie die Optoakustik, könnten in Zukunft entsprechende molekulare Gewebeinformation, selbst bei den kleinsten Patientinnen und Patienten, liefern. Mittels dieses molekular-sensitiven Ultraschalls können zudem Erkenntnisse aus Tierversuchen direkt in die klinische Anwendung überführt werden. Im Rahmen Exzellenzstipendiums werden die Forschenden neue diagnostische Bereiche für die Optoakustik bei Darm- und Lebererkrankungen in translationalen Studien erschließen. Ziel ist es, die Optoakustik in der klinischen Diagnostik bei Kindern und Jugendlichen zu etablieren und ihnen damit invasive Eingriffe zu ersparen.

PD Dr. Eva Schrezenmeier, Klinik m.S. Nephrologie und Internistische Intensivmedizin, Charité-Universitätsmedizin Berlin
Projekt: Wirksamere Therapien für immunvermittelte Nierenerkrankungen durch ein vertieftes Verständnis der Entwicklung von B-Zellen und Plasmazellen
Immunvermittelte Nierenerkrankungen variieren stark in ihren Verläufen, von mild und selbstlimitierend bis hin zu schwer und unzureichend behandelbar. B- und Plasmazellen spielen eine Schlüsselrolle in ihrer Pathogenese. Das Ziel dieses Projektes ist es, die Unterschiede in der Entstehung und Aufrechterhaltung des B- und Plasmazellgedächtnisses zwischen verschiedenen Verlaufsformen immunvermittelter Nierenerkrankungen zu erforschen und daraus neue Therapien abzuleiten.