
Die EKFS hat sechs Else Kröner Memorialstipendiaten ausgewählt, die durch eine zweijährige Freistellung von klinischen Aufgaben ein erfolgversprechendes medizinisches Forschungsvorhaben umsetzen werden. Das Individualstipendium ist mit jeweils 230.000 Euro dotiert.
Folgende Wissenschaftler erhalten in diesem Jahr ein Memorialstipendium:

Dr. Michael S. Balzer, Medizinische Klinik mit Schwerpunkt Nephrologie, Charité – Universitätsmedizin
Projekt: Endophenotypes of kidney disease progression at the single cell level
Akutes Nierenversagen (ANV) führt trotz immenser Reparaturreserven der Niere häufig zu chronischer Nierenerkrankung – weltweit sind über 850 Millionen Menschen davon betroffen. Es fehlen Medikamente, die eine Verschlechterung der Nierenfunktion nach akutem Schaden verhindern oder aufhalten könnten. Moderne Einzelzell-Analysetechniken haben das Potenzial, unser Wissen über Krankheitsprozesse auf zellulärer Ebene fundamental zu verändern. Dieses Projekt soll mit der Identifizierung zellulärer Signaturen, den sogenannten „Endophänotypen”, welche zum einen erfolgreiche Organreparatur und zum anderen fehlgeleitete, in Vernarbung mündende Regeneration abbilden, klassische Denkmuster in der Charakterisierung von Nierenerkrankungen revolutionieren und so die Grundlage für die Entwicklung gezielter Therapien von ANV schaffen.

Dr. Julius C. Fischer, Klinik und Poliklinik für Radioonkologie und Strahlentherapie, Technische Universität München (TUM)
Projekt: Einfluss hormoneller Regelkreise auf die Antitumor-Immunantwort nach Strahlentherapie
In der Nachwuchsarbeitsgruppe beschäftigen sich Dr. Fischer und sein Team mit Mechanismen, um Therapieerfolge nach der Strahlentherapie oder kombinierten Strahlenimmuntherapien zu verbessern. Gleichzeitig erforschen sie zugrundeliegende Mechanismen und Risiken solcher Kombinationstherapien. Im Rahmen dieses experimentellen Projekts wollen sie den Einfluss spezifischer hormoneller Mechanismen auf die Entwicklung einer Antitumor-Immunantwort nach Strahlentherapie bzw. der Kombination aus Strahlentherapie und Immun-Checkpoint-Blockade erforschen. Dem Projekt liegt die Hypothese zugrunde, dass es nach der Strahlentherapie zur Aktivierung spezifischer hormoneller Regelkreise kommt, die solche Therapien beeinflussen. Dieses Wissen könnte in Zukunft für die Optimierung von Krebstherapien genutzt werden.
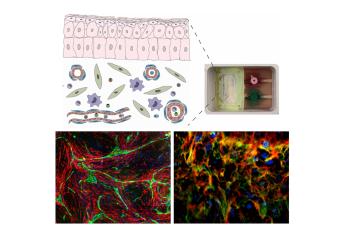
Dr. Alexandru-Emil Matei, Klinik für Rheumatologie und Hiller Forschungszentrum, Universitätsklinikum Düsseldorf und Heinrich-Heine-Universität Düsseldorf
Projekt: Fortgeschrittene organotypische Fibrosemodelle für pathophysiologische Studien und zur Erprobung neuer therapeutischer Ansätze
Fibrotische Umbauprozesse mit pathologischer Anhäufung von Bindegewebe, wie beispielweise in der Systemischen Sklerose (einer systemischen Bindegewebserkrankung), sind eine häufige Ursache für Morbidität und Mortalität. Die aktuell verwendeten Fibrosemodelle für die Testung antifibrotischer Substanzen reproduzieren aufgrund Spezies-spezifischer Unterschiede oder zu großer Vereinfachung nur eingeschränkt die Pathogenese fibrotischer Erkrankungen. Im Rahmen des beantragten Projekts evaluieren die Forschenden komplementäre Fibrosemodelle mit verschiedenen humanen Zelltypen, von unterschiedlicher Komplexität und Durchsatzkapazität. Diese Modelle sollen die Entstehung und den Verlauf fibrotischer Erkrankungen besser als gängige Modelle nachstellen und somit eine höhere Vorhersagekraft für die Verwendung antifibrotischer Substanzen im Menschen bieten können.

Dr. Julien H. Park, Klinik für Kinder- und Jugendmedizin – Allgemeine Pädiatrie, Universitätsklinikum Münster
Projekt: N-Acetylmannosamin als potentielle Therapie für Golgi-Homöostasestörungen
Glykosylierungserkrankungen (Congenital disorders of glycosylation , CDG) sind erblich bedingte Stoffwechselstörungen, die zu schwerwiegenden, potenziell tödlichen Multisystemerkrankungen führen. Das Projekt untersucht, wie es durch das Fehlen der Sialinsäure zu Zellschädigung kommt. Es wird der Effekt des Vorläufermoleküls N-Acetylmannosamin auf Zuckerketten und Stoffwechselvorgängen am Zellmodell untersucht, um langfristig eine Therapie zu entwickeln. Aufgrund der wichtigen Rolle der Hyposialylierung bei Erkrankungen des zentralen Nervensystems können die gewonnenen Erkenntnisse das Verständnis für diese häufigen Krankheitsbilder vertiefen.
Dr. Robert Seifert, Klinik für Nuklearmedizin, Universitätsklinikum Essen und Klinik für Nuklearmedizin, Universitätsklinikum Münster
Projekt: Innovative Strategien zur Optimierung von randomisierten therapeutischen Studien durch molekulare Bildgebung und künstliche Intelligenz
Das prostataspezifische Membranantigen (PSMA) ist ein Erkennungsmolekül auf Prostatakrebszellen, das zur Therapie von Patienten mit fortgeschrittenem Prostatakrebs als Zielstruktur genutzt wird. Die PSMA-Therapie kann eine hohe Effizienz aufweisen und die Überlebenszeit von Patienten verlängern. Aktuell ist jedoch unklar, welche Patienten von der Therapie profitieren. Es soll daher versucht werden, ob durch künstliche Intelligenz und die Charakteristik aller Metastasen sowie weiterer Parameter die Einschlusskriterien für die PSMA-Therapie verbessert werden können. Die Erkenntnisse verbessern das Verständnis des Prostatakarzinoms und die Methoden zur Optimierung der Einschlusskriterien können ebenso auf andere Krebserkrankungen übertragen werden.
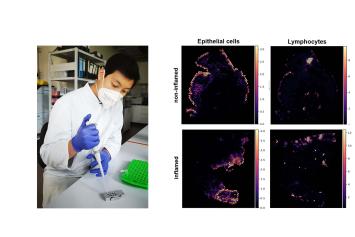
Dr. Florian Tran, Klinik für Innere Medizin I & Institut für klinische Molekularbiologie, UKSH Kiel
Projekt: Longitudinales, räumlich aufgelöstes Multi-Omics-Profiling zur Untersuchung zur Charakterisierung von Remission unter Biologika-Therapie bei Colitis Ulcerosa.
Colitis Ulcerosa (CU) ist eine nicht heilbare chronische Darmkrankheit, welche die Lebensqualität Betroffener stark einschränken kann. Trotz der Verfügbarkeit neuer Behandlungsansätze lässt sich bei vielen Patientinnen und Patienten eine Remission (Freiheit von Symptomen und Entzündung) nicht langfristig erreichen. In diesem Projekt werden mittels moderner Sequenziertechnologien – hierbei handelt es sich um komplexe molekulare Signale mit räumlicher Auflösung (räumliche Multi-Omics) – Darmgewebsproben von Patientinnen und Patienten mit CU im Rahmen einer Biologika-Therapie untersucht, um neue molekulare Prädiktoren für langfristige Remission zu identifizieren. Daher wird dieses Projekt zur Biomarker-basierten Präzisionsmedizin für CU-Patientinnen und Patienten beitragen.